Die Steuerung der Adhäsion von Bakterien oder anderen Mikroorganismen auf der Oberfläche von Biomaterialien ist ein entscheidender Faktor für den klinischen Erfolg implantierbarer Materialien. Am Fraunhofer IGB entwickeln wir Oberflächenbeschichtungen, die sowohl aktiv durch Wirkstofffreisetzung oder passiv durch Verminderung der Bakterienadhäsion den Aufbau von Biofilmen unterdrücken.
Vermeidung der Adhäsion von Mikroorganismen durch antimikrobielle Oberflächen
Herausforderung: Vermeidung und Bekämpfung von Biofilmen
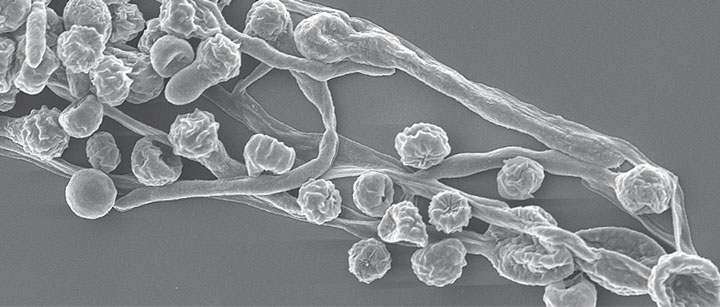
Haben sich Biofilme erst einmal an einer Oberfläche niedergelassen, ist ihnen meist schwer beizukommen. In dieser Lebensform sind Mikroorganismen deutlich resistenter als Einzelzellen und widerstehen in vielen Fällen selbst hoch dosierten Desinfektions- und Reinigungsmitteln.
Antimikrobielle Ausrüstung von Oberflächen vermeidet Biofilme
Um Biofilme schon an der Entstehung zu hindern, ist daher die Anwendung geeigneter antimikrobieller Oberflächenmodifikationen angezeigt, beispielsweise durch Anbindung biozider oder auch natürlicher antimikrobieller Substanzen oder eine photokatalytische Ausrüstung. Eine entsprechende Oberflächengestaltung kann die mikrobielle Adhäsion an der Materialoberfläche oder die Vermehrung der Zellen von vorneherein unterbinden.
Am Fraunhofer IGB haben Grenzflächenforscher in Zusammenarbeit mit Mikrobiologen und Zellbiologen bereits verschiedene Oberflächenausrüstungen entwickelt. Ihre Charakterisierung kann mithilfe physikalischer und chemischer Verfahren erfolgen, ihre biologische Wirksamkeit lässt sich mit lebenden Systemen nachweisen.
Technische Lösungen zur Vermeidung und Bekämpfung von mikrobiellem Wachstum an Oberflächen
Physikalische Maßnahmen
- Veränderung von Umgebungsbedingungen (z. B. Kühlung oder Erhitzung)
- Beeinflussung durch Änderung der Strömungsbedingungen oder mechanische Entfernung
- Strahlung
- Oberflächeneigenschaften
Chemische Maßnahmen
- Reinigung und/oder Desinfektion
- pH-Wert-Änderungen Eigenschaften von Oberflächen
Biologische Maßnahmen
- Antibiotisch wirksame Stoffe
- Störung der Zell-Zell-Kommunikation
Schichtsysteme zur gezielten Freisetzung natürlicher antimikrobieller Verbindungen
Zur Vermeidung der Biofilmbildung haben wir auch die Wirkung natürlich vorkommender antimikrobiell aktiver Verbindungen wie Pflanzenextrakte, kationische Peptide und Enzyme untersucht. Da es für eine technische Nutzung notwendig ist, Wirkstoffe in einer geeigneten Darreichungsform zu applizieren, entwickeln wir Schichtsysteme zur längerfristigen und gezielten Freisetzung und, besonders im Fall von Biomolekülen, zur längerfristigen Erhaltung ihrer Funktion. Die Applikationsart der Wirkstoffe hängt dabei vom Einsatzbereich, der Art und Geometrie der Oberfläche und dem zu immobilisierenden Wirkstoff ab.
Immobilisierung in polymerer Matrix
Eine Möglichkeit zur Immobilisierung aktiver Biomoleküle ist die Einbettung in eine polymere Matrix als Beschichtung, aus welcher der Wirkstoff über einen bestimmten Zeitraum freigesetzt wird.
Wir realisierten aktive Schichten mit Lysozym, DNAse und LL-37. Lysozyme sind Enzyme des angeborenen Immunsystems und beschädigen die Bakterienzellwand. Das humane antimikrobielle Peptid LL-37 wird ebenfalls vom Immunsystem gebildet und zerstört die Zellwände zahlreicher Gram-positiver und Gram-negativer Bakterien. Zudem ist es sehr proteolysestabil. Das Enzym DNAse spaltet DNA. Da Biofilme zu einem großen Anteil aus der freigesetzten DNA abgestorbener Mikroorganismen bestehen, können DNAsen den Biofilm reduzieren.
Die polymere Matrix wurde aus kurzkettigen Poly(ethylenglykol)-Diacrylaten durch UV-Bestrahlung aufgebaut. Dazu wurde der Wirkstoff mit Additiven in die wässrige Polymerlösung gegeben, auf die gewünschte Oberfläche gebracht und für 3 Sekunden bestrahlt. Durch die Bestrahlung vernetzen die Polymerketten und der Wirkstoff wird so im Hydrogel eingebettet. Wir wiesen nach, dass die angewandte Bestrahlungsdauer zur Netzwerkbildung ausreicht und das Biomolekül nicht wesentlich in seiner Sekundärstruktur oder Aktivität verändert wird.
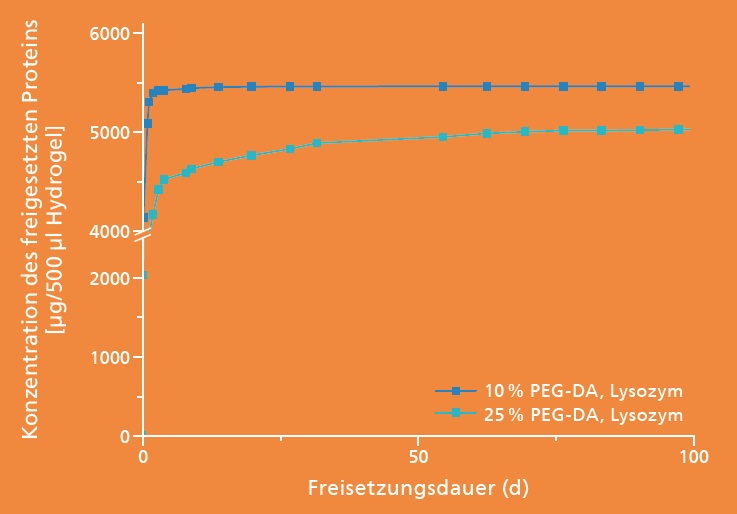
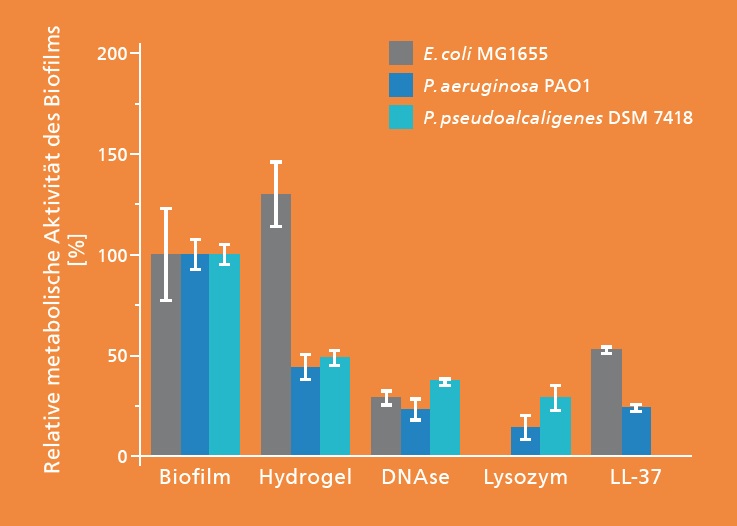
Steuerung der Freisetzung und antimikrobielle Wirkung
Das Freisetzungsverhalten wurde bei Raumtemperatur in einer phosphatgepufferten Salzlösung untersucht, welche regelmäßig gewechselt wurde. Die Abbildung links zeigt die freigesetzte Menge Lysozym über 100 Tage in Abhängigkeit unterschiedlicher Netzwerkdichten. Der größte Teil wird in den ersten Tagen freigesetzt, aber auch nach 100 Tagen wurde noch eine Abgabe gemessen. Zu diesem Zeitpunkt waren 50 Prozent des gesamten eingebrachten Lysozyms freigesetzt. Die Freisetzung selbst kann über die präparierte Netzwerkdichte eingestellt werden.
Die beschriebenen Systeme wurden mit E. coli, P. aeruginosa und P. pseudoalcaligenes auf ihre antimikrobielle, bakteriostatische Wirkung untersucht. Ihre Wirkung wurde auf planktonische und Biofilmzellen überprüft. Die Abbildung links zeigt die statistisch signifikante Reduzierung der metabolischen Aktivität der untersuchten Mikroorganismen im Vergleich zum Referenz-Biofilm durch die präparierten Systeme. Für Hydrogele mit Lysozym und LL-37 wurde auch eine statistisch signifikante Reduzierung der planktonischen Zellzahl erreicht.
Ausblick
Wir konnten zeigen, dass natürliche antimikrobielle Wirkstoffe unter Funktionserhalt in Depotschichten eingebettet werden können und ihre Freisetzung über die Gestaltung dieser Schicht steuerbar ist. Auf die untersuchten Mikroorganismen wirkten die präparierten Systeme antimikrobiell. Antimikrobielle Naturstoffe besitzen meist ein enges Wirkspektrum, daher müssen für eine technische Anwendung gegebenenfalls Wirkstoffkombinationen für die vorhandenen, zu vermeidenden Mikroorganismen eingesetzt werden. Die Depotschicht ist dabei jeweils auf die freizusetzenden Wirkstoffe abzustimmen.
Literatur
[1] Weber, C.; Burger-Kentischer, A.; Müller, M.; Trick, I.; Hirth, T. (2011) Biofilmvermeidung durch natürliche Wirkstoffe – gezielte und langfristige Freisetzung durch ein PEG-basiertes Depotsystem, Biomaterialien 12: 2
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB