Proteine sind Makromoleküle, die in der Zelle in der Regel aus 20 kanonischen Aminosäuren über Peptidbindungen aufgebaut werden. Die einzigartige Aminosäureabfolge jedes einzelnen Proteins definiert dabei dessen biologische Funktion und dessen physikalisch-chemische Eigenschaften. Wissenschaftlich und wirtschaftlich bedeutsam sind Proteine als hochspezifische Enzyme mit definierten, katalytischen Eigenschaften für die Synthese komplexer Verbindungen, aber auch als therapeutisch einsetzbare Wirkstoffe. Daher werden inzwischen Proteine standardmäßig rekombinant hergestellt.
Synthetische Proteine zur Analyse biomolekularer Interaktionen in vivo
Neue Möglichkeiten durch synthetische Biologie
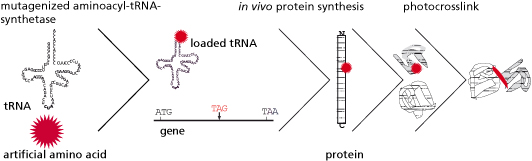
Einen der aktuellsten und vielversprechendsten Ansätze zur Herstellung von Proteinen mit neuen physikalisch-chemischen Eigenschaften bietet das junge Forschungsfeld der synthetischen Biologie. Das zugrunde liegende Prinzip sieht dabei die Herstellung rekombinanter Organismen mit Hilfe standardisierter Bausteine und ingenieurwissenschaftlicher Prinzipien vor. Neben den natürlichen Standard-Aminosäuren können hierbei auch artifizielle synthetische Aminosäuren positionsspezifisch und in vivo in die Peptidsequenz eingebaut werden. Die neuen funktionellen Gruppen können beispielsweise die physiologische Funktion des Proteins verbessern oder dem Protein über das natürliche Spektrum hinausgehende, einzigartige Eigenschaften verleihen, wie die Fähigkeit zur Kreuzvernetzung, Photoaktivierbarkeit oder die Möglichkeit einer selektiven, posttranslationalen Modifizierung.
Etablierung der Technologie am Modellsystem Saccharomyces cerevisiae
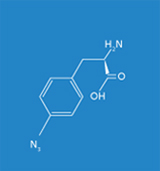
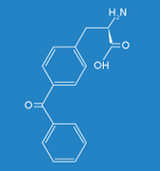
Ziel der hier dargestellten Forschungsarbeiten am Fraunhofer IGB war es, synthetische Proteine basierend auf dem positionsspezifischen Einbau artifizieller Aminosäuren wie Azido- oder Benzoylphenylalanin in vivo herzustellen, um mit Hilfe der synthetischen Proteine biomolekulare Interaktionen (Protein-DNA- / Protein-Protein-Interaktionen) in Eukaryoten unter physiologischen Bedingungen in vivo untersuchen zu können. Die Etablierung dieser Technologie erfolgte mit dem Transkriptionsfaktor Gal4p in Saccharomyces cerevisiae als Modellsystem.
Prinzip
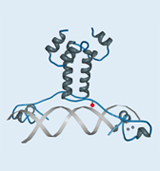
Häufig sind die Interaktionen eines Proteins mit seiner Umgebung nicht stabil, sondern nur temporär. Die Bindung zwischen den Interaktionspartnern kann beispielsweise dissoziieren, sobald die zu untersuchenden biologischen Systeme zur Analyse aufgeschlossen und zerstört werden. Aus diesem Grund ist es für die Untersuchung von Protein-Protein-Interaktionen essenziell, die entsprechenden biomolekularen Wechselwirkungen kovalent zu fixieren. Der Zeitpunkt der Fixierung soll dabei beliebig wählbar und spezifisch für die Interaktion sein. Um diesem Anspruch gerecht zu werden, wenden wir das Prinzip des erweiterten genetischen Codes an. Dabei wird während der Proteinsynthese statt einer natürlichen eine artifizielle Aminosäure an eine exakt definierte Position in die Interaktionsdomäne des Zielproteins, dem Transkriptionsfaktor Gal4p, in vivo eingebaut. Die zusätzlichen Seitengruppen der verwendeteten artifiziellen Aminosäuren sind photoaktivierbar: In Abhängigkeit von UV-Licht werden die Seitengruppen aktiviert und bilden kovalente Bindungen zum Interaktionspartner aus. Die so fest aneinander gebundenen Proteine können dann aus den Zellen isoliert, anschließend angereichert und mittels Massenspektrometrie identifiziert werden.
Ausblick
Die Technologie zur Herstellung von synthetischen Proteinen zur Analyse von Protein-Protein-Interaktionen soll universell eingesetzt werden und so zu einem besseren Verständnis komplexer Regulationsnetzwerke bei der Entstehung von Krankheiten oder zur Aufklärung von Stoffwechselwegen beitragen.
Förderung
Wir danken der Fraunhofer-Gesellschaft für die Förderung der Arbeiten zur Etablierung synthetischer Proteine im Rahmen des Programms Mittelstandsorientierte Eigenforschung (MEF) unter dem Projekttitel »Verfahren zur genomweiten Identifizierung regulatorischer Protein-DNA-Interaktionen«.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB