Die konfokale Raman Mikrospektroskopie ermöglicht die ortsaufgelöste Identifikation von chemischen, biologischen und mineralischen Komponenten in komplexen heterogenen Proben.
Messprinzip und Einsatzgebiete
Ähnlich wie die Infrarot‑Spektroskopie nutzt die Raman‑Spektroskopie die Wechselwirkung von Licht mit Materie und erlaubt damit Einblicke in den molekularen Aufbau und die Eigenschaften eines Materials. Ein großer Vorteil der Raman‑Spektroskopie ist, dass bei der Untersuchung von Proben in wässrigen Medien keine störende Wasser‑Bande im Spektrum vorhanden ist.
Prinzipiell kann die Raman‑basierte Analyse und Charakterisierung auf unterschiedlichsten Materialien, von Kunststoffen über Medizin- und Pharmaprodukte bis hin zu biologischen Geweben angewandt werden.
Automatisierte und hochflexible Raman-Analysen mit Leica-Mikroskopen und CARS-Einheit
Mit dem konfokalen inVia™ Qontor Raman‑Mikroskop von Renishaw steht am Fraunhofer IGB ein automatisiertes und hochflexibles Mikroskop für die Forschung zu Verfügung, welches für Untersuchungen in allen Geschäftsfeldern des IGB (Gesundheit, Umwelt und Nachhaltige Chemie) eingesetzt werden kann.
Das System ist mit zwei Leica‑Mikroskopen ausgestattet, sodass sowohl Messungen in Auflicht (mit Einhausung) als auch invers in Transmission möglich sind. Das System verfügt über zwei Laser mit 532 nm (max. 50 mW) und 785 nm (max. 300 mW) und ist mit einer CARS‑Einheit (coherent anti‑Stokes Raman spectroscopy) ausgestattet.
Analyse chemischer Verbindungen und Materialien
Eine häufige Anwendung der Raman‑Mikroskopie ist die Analyse chemischer Verbindungen und Materialien (z. B. Katalysatoren, Flüssigkeiten etc.). Am Fraunhofer IGB wurden hier in der Vergangenheit u. a. verschiedene Hydrogele untersucht.
Identifizierung von Stoffen in Proben unbekannter Zusammensetzung
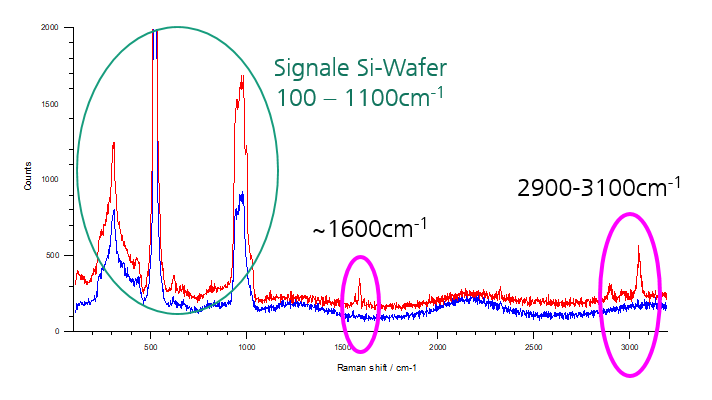
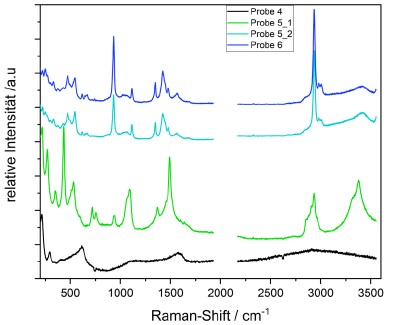
Darüber hinaus ermöglicht die Raman‑Mikroskopie anhand des für jeden Stoff typischen und einzigartigen Bandenmusters eine zerstörungsfreie Identifikation der chemischen Zusammensetzung unbekannter Proben. So konnten wir am Institut beispielweise den Entstehungsmechanismus chemischer Korrosion an Kupferproben ermitteln und damit eine biologische Ursache ausschließen.
Qualitative und quantitative Analyse von Zellen in biologischen Proben
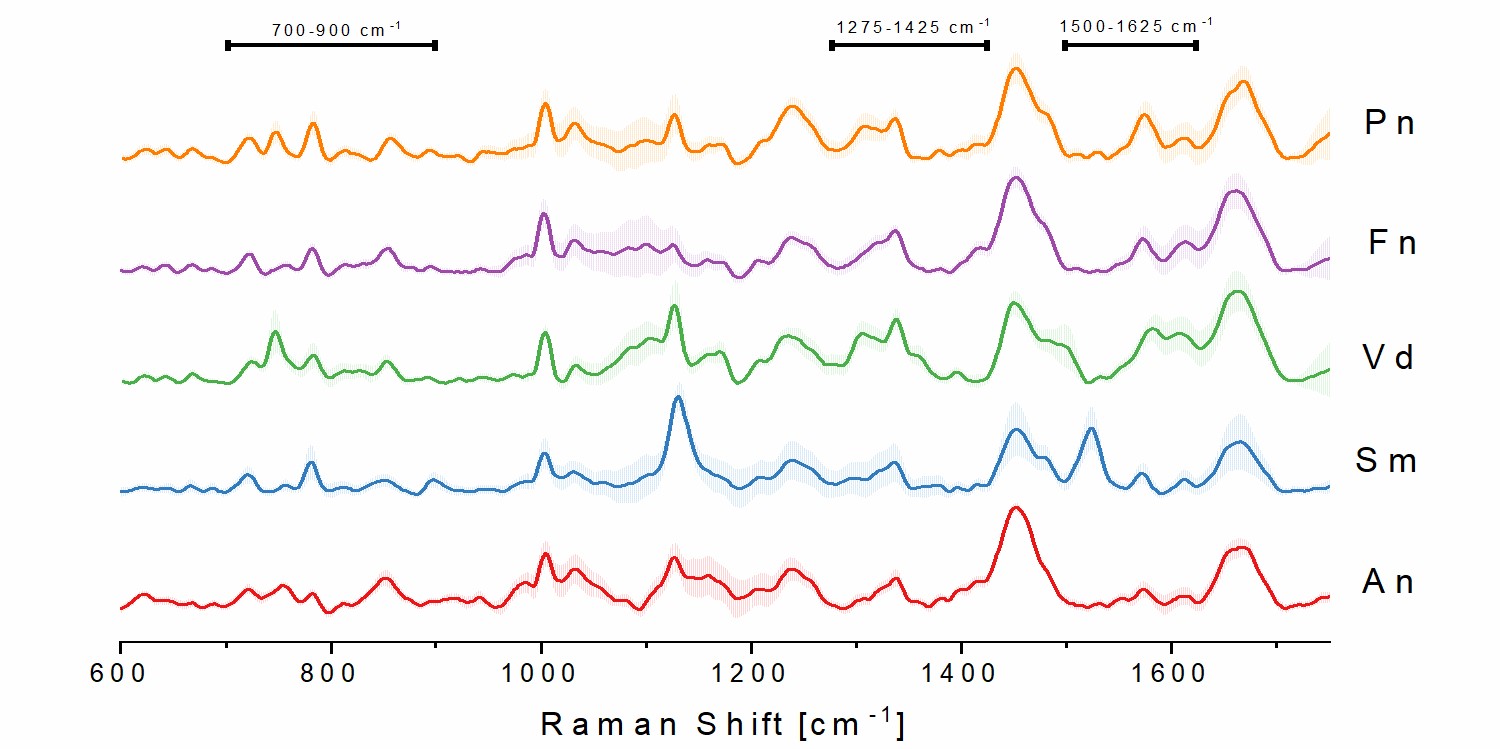
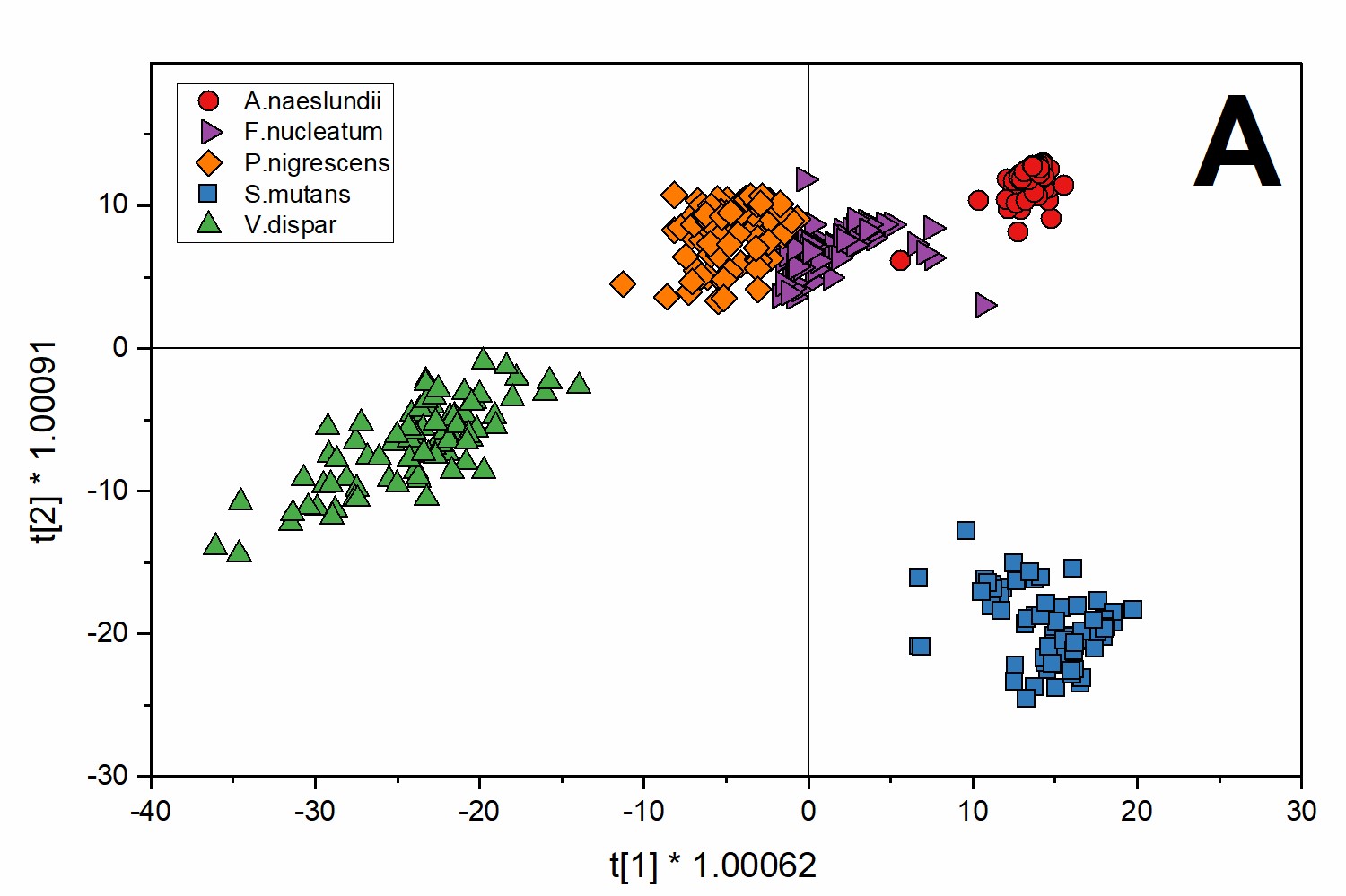
Auch in der Biologie findet die Raman‑Spektroskopie Anwendung. Sie wird zur Analyse verschiedener Zellsysteme genutzt. Am Fraunhofer IGB verfolgen wir Ansätze zur Differenzierung unterschiedliche Mikroorganismen in Biofilmen, zur Unterscheidung von Lebend- und Totzellen durch Raman‑Spektren und zur Quantifizierung von Mikroorganismen in fluiden Systemen.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB