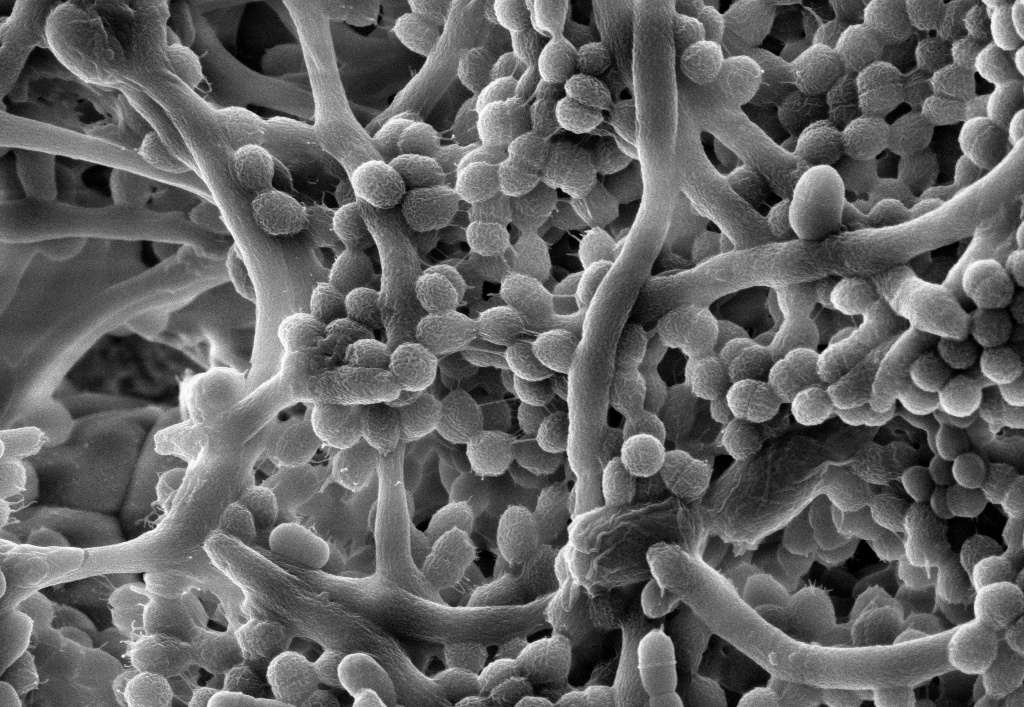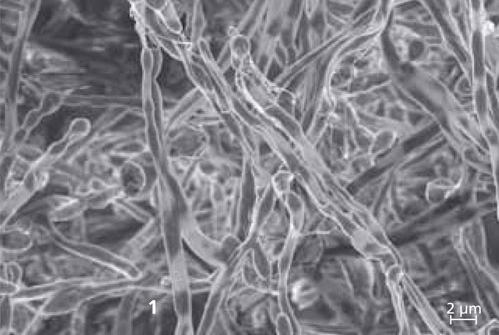
Mikroorganismen an Oberflächen sind in der Natur weit verbreitet. Bakterien, Pilze und Algen haben sich an ein Wachstum auf verschiedenen Oberflächen angepasst und profitieren in erheblichem Maß von dieser an den jeweiligen Standort adaptierten Lebensweise, beispielsweise auf Steinen in einem Bach – aber auch in Rohrleitungen. Sichtbar wird ihr Wachstum für das menschliche Auge dann, wenn sich Biofilme in exorbitantem Ausmaß entwickeln. Häufig bewirkt das mikrobielle Wachstum eine Schädigung des Materials oder eine Funktionsminderung technischer Einrichtungen.
Wechselwirkungen zwischen mikrobiellen Zellen und Oberflächen
Am Fraunhofer IGB arbeiten wir seit mehreren Jahren an Fragestellungen, bei denen die Wechselwirkungen zwischen mikrobiellen Zellen und Oberflächen bzw. die Bildung von Biofilmen eine Rolle spielen. Einerseits nutzen wir Biofilme, z. B. durch gezielte Immobilisierung von Mikroorganismen an einem Trägermaterial, zur Produktion von Wertstoffen oder bei der Abwasserreinigung.
Auch die Vermeidung und Bekämpfung von Biofilmen – dort wo sie unerwünscht sind und Schäden verursachen – unterstützen wir durch unsere Forschung. So haben wir Prüfverfahren für die Untersuchung von Biofilmen entwickelt und untersuchen Oberflächen und Bauteile in Medizintechnik, Bau, Abwasserreinigung und Hygiene auf mikrobiologische Kontaminationen.
Beispiele für Schäden durch Biofilme sind die Verschlechterung des Wirkungsgrades von Wärmetauschern oder Klimaanlagen. Auch im Gesundheitssektor werden enorme Anstrengungen unternommen, um das Wachstum von Biofilmen an natürlichen Oberflächen wie Zahnmaterial, aber auch an synthetischen Materialien wie Implantaten, Kathetern oder medizinischen Geräten zu verhindern – auch wegen enormer Folgekosten im Falle einer Schädigung des Menschen.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB