»Um im Labor Gewebe aufzubauen, die ebenso gut funktionieren wie ihre natürlichen Vorbilder, benötigen wir neben dem optimalen Biomaterial auch Herstellungsprozesse, die uns hinsichtlich der Formgebung möglichst wenig Grenzen setzen«, erläutert Borchers.
»Additive Verfahren bieten diesbezüglich große Flexibilität. Mit ihrer Hilfe lassen sich dreidimensionale Objekte, die zuvor am Computer entworfen wurden, Schicht für Schicht aufbauen«, so Weber. Die flexible Formgebung ist dabei vor allem in Hinblick auf die Vision, gedruckte biologische Implantate zu fertigen, von Bedeutung. Denn moderne bildgebende Diagnoseverfahren, die heute vielfach schon im medizinischen Alltag eingesetzt werden, können genau die digitalen 3D-Daten liefern, die für individualisierte Implantate erforderlich sind.
Borchers ergänzt: »Die additive Verarbeitung von Gewebematrix und Zellen zu Gewebemodellen bietet aber noch einen weiteren Vorteil: Automatisierung und digitale Steuerung könnten in Zukunft garantieren, dass die Fertigung unter kontrollierten und standardisierten Bedingungen erfolgen kann«.
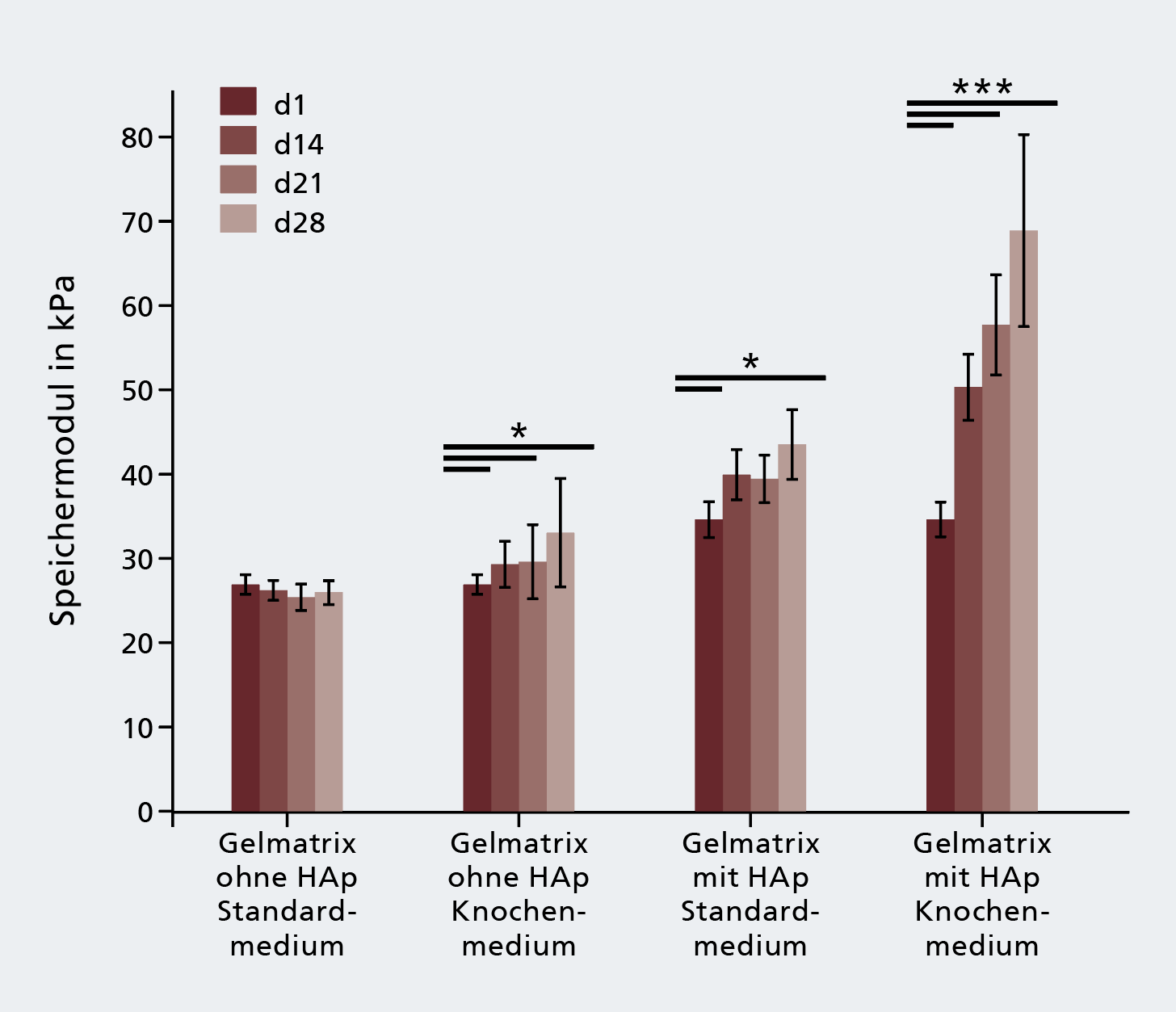
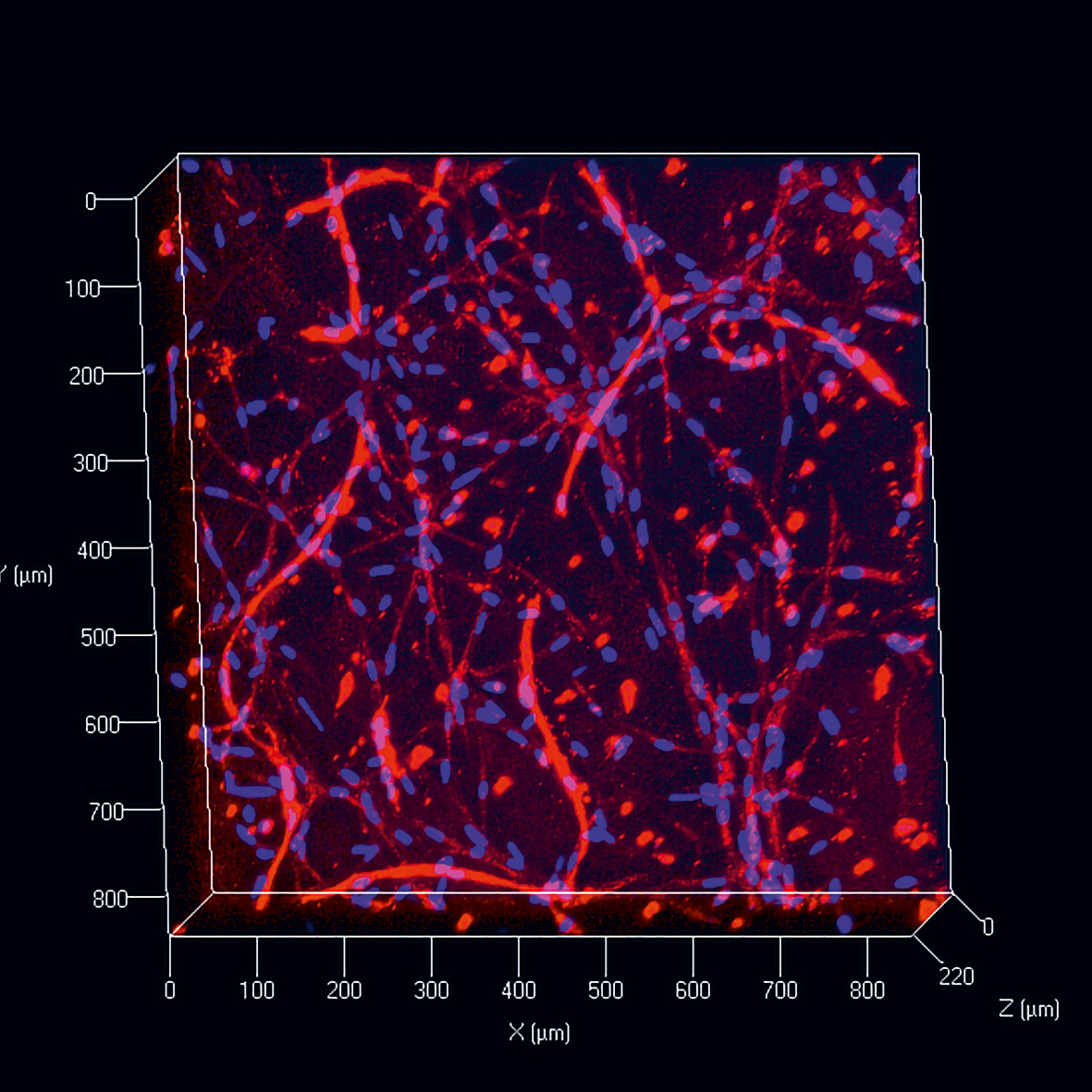
Auf dem heutigen Stand der Technik werden 3D-Druckverfahren genutzt, um in einfach aufgebauten Gewebemodellen unterschiedliche Zellen und Biomaterialien sowie Strukturen wie Perfusionskanäle für die Versorgung der Zellen zu kombinieren [1]. Der Forschungszweig, der sich mit dem Aufbau von biologischen Strukturen mithilfe von additiven Fertigungsverfahren befasst, wird als Bioprinting bezeichnet.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB