Bakteriophagen sind in einigen Ländern eine vielfach eingesetzte Alternative zu Antibiotika. Am IGB entwickeln wir Plattformen für das Engineering und die Herstellung von Phagen. Bei der Bekämpfung von Infektionen spielt das körpereigene Immunsystem eine zentrale Rolle. Die Forschung am Fraunhofer IGB fokussiert daher zudem auf das Screening immunmodulierender Wirkstoffe sowie auf Testsysteme zur Untersuchung der zellulären Mechanismen, die bei einer Infektion in Gang gesetzt werden.
Infektionen – Wirkstoffentwicklung
Inhaltsübersicht
Bakteriophagen – Neue Waffe gegen multiresistente Erreger
Bakteriophagen sind Viren, die spezifisch Bakterien infizieren und abtöten können. Sie werden bereits seit langem vor allem in Georgien zur Behandlung von Infektionserkrankungen eingesetzt, wurden in Westeuropa jedoch durch Antibiotika verdrängt. Neuerdings werden große Hoffnungen in Bakteriophagen zur spezifischen und wirkungsvollen Therapie von bakteriellen Infektionserkrankungen gesetzt.
Besondere Bedeutung nimmt heute dabei die Behandlung von multiresistenten Bakterien wie Methicillin-resistenten Staphylococcus aureus (MRSA) oder Extended Spectrum β-Lactamase (ESBL) produzierenden Erregern ein. Hier ist das IGB gemeinsam mit dem Fraunhofer ITEM und IPA auf dem Weg, Bakteriophagen zu engineeren und Prozesse zu ihrer personalisierten Herstellung zu etablieren.
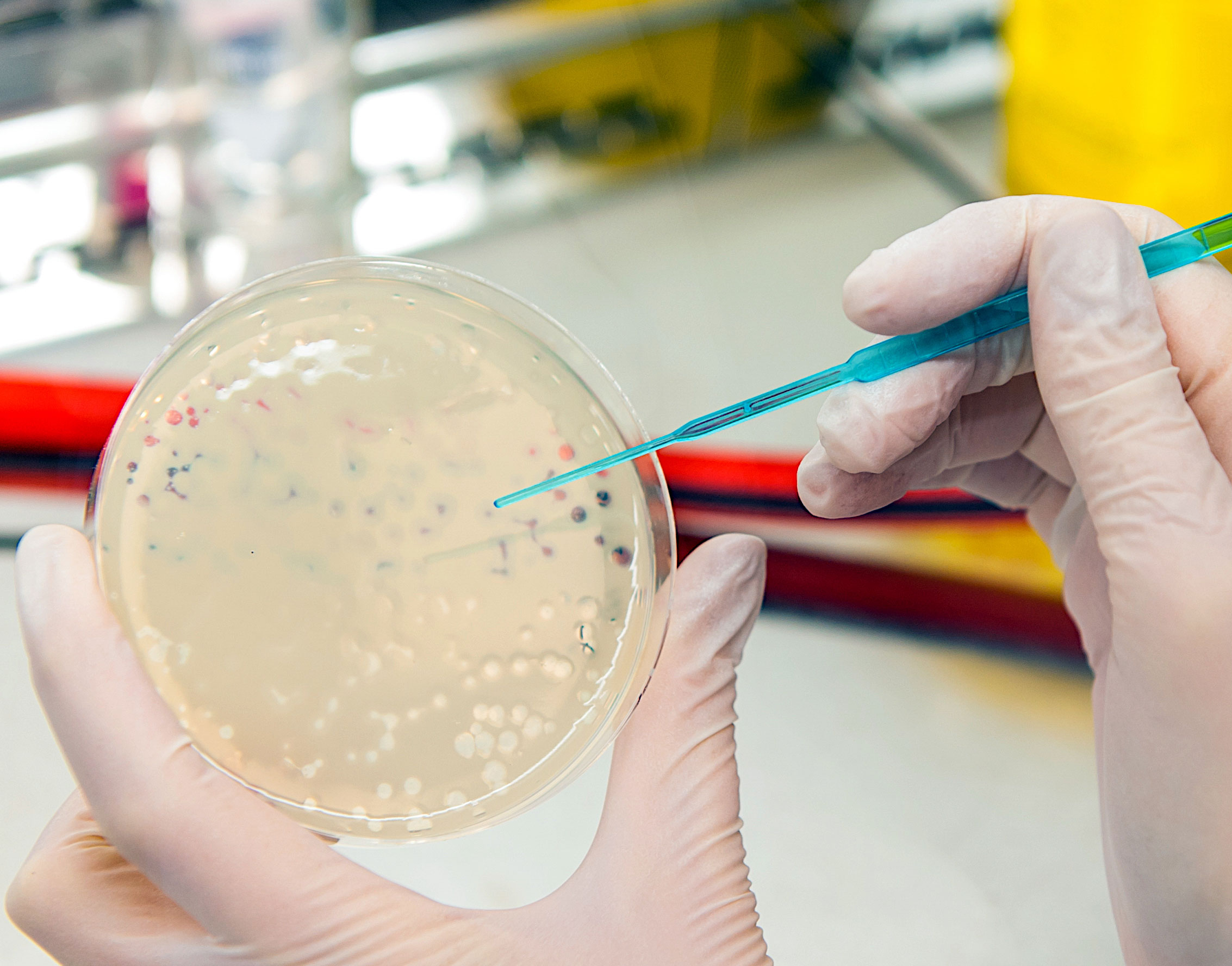
Erfahrung im Umgang mit Bakteriophagen wurden bereits im Zusammenhang mit der Bekämpfung von Karies gesammelt, der Nummer 1 der chronischen Erkrankungen. Mit dem Projekt Kari-EX konnte eine vollkommen neuartige, kostengünstige und sichere Methode zur ursächlichen Bekämpfung von Karies durch die Integration von Phagen in Kaugummi entwickelt werden. Kari-EX ist somit Wegbereiter für den Einsatz von Phagen im Kampf gegen bakteriell verursachte Infektionskrankheiten, insbesondere bei multiresistenten Keimen, wo Antibiotika derzeit dramatisch an ihre Grenzen stoßen.
Identifizierung neuer Agonisten und Antagonisten von Immunrezeptoren für die Therapie von Entzündungsprozessen
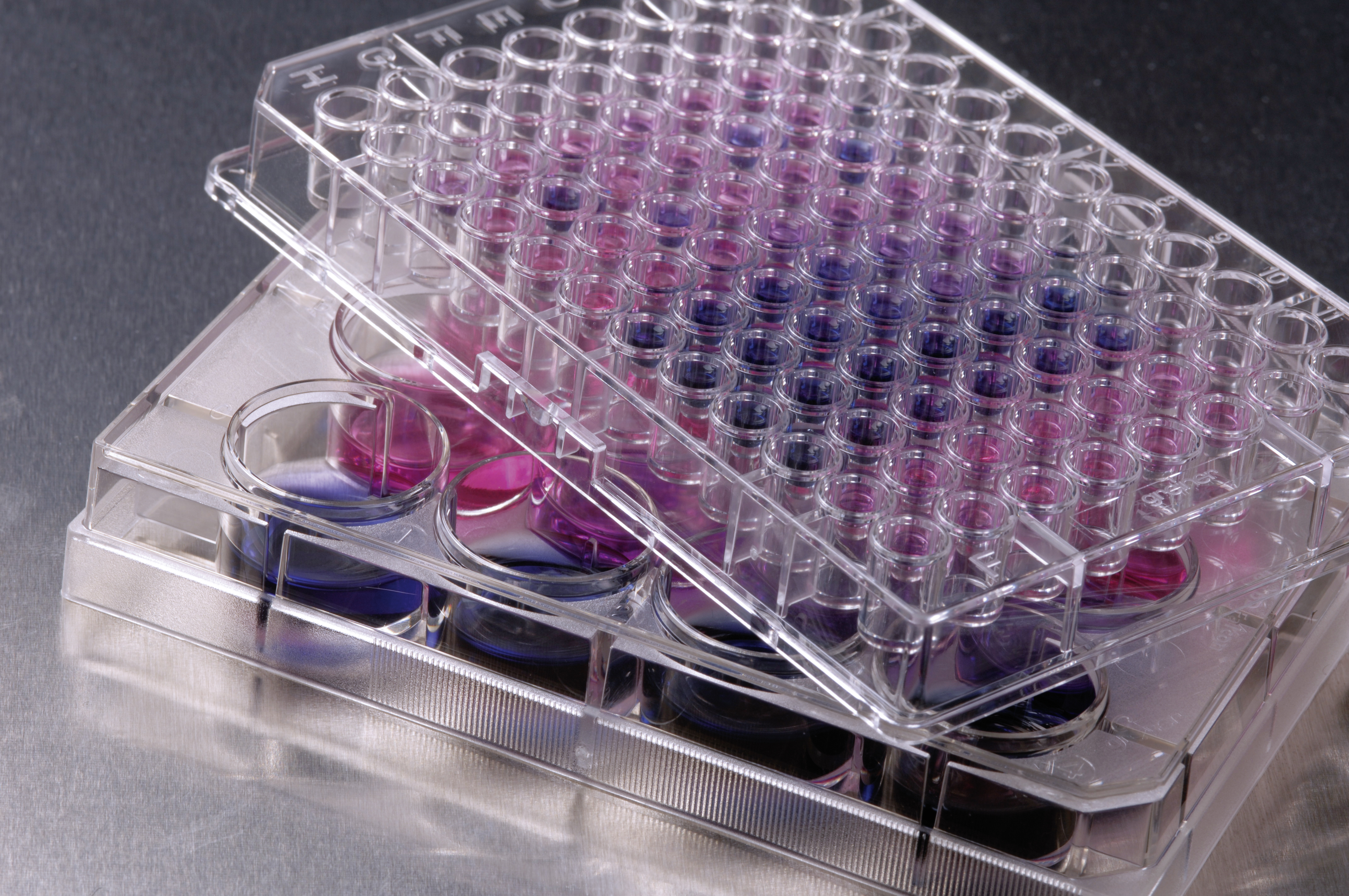
Der Einsatz von Agonisten und Antagonisten von Immunrezeptoren ist ein neuer therapeutischer Ansatz für die Therapie von pathologischen Entzündungsprozessen, wie sie bei Infektionserkrankungen (bis hin zur Sepsis), Allergien und Autoimmunerkrankungen eine Rolle spielen. Selbst bei der Beseitigung von Tumorzellen sind die Rezeptoren des angeborenen Immunsystems beteiligt.
Agonisten der Immunrezeptoren stimulieren das angeborene Immunsystem und werden häufig als Wirkstoff-Adjuvanzien eingesetzt, während Antagonisten Entzündungsprozesse hemmen. Das Fraunhofer IGB verfügt über eine Reihe von mammalischen Ganzzell-Biosensor-Assays, welche die Aktivität aller bekannten humanen TLR-Rezeptoren und einiger C-Lectine über spektroskopische Verfahren im High-Throughput-Screening (HTS) messen. Mit diesen Verfahren können so funktionelle Moleküle identifiziert werden, die potenzielle Arzneimittelkandidaten für die Prävention und Therapie immunologischer Erkrankungen darstellen.
Erste TLR9-Antagonisten konnten bereits mit Partnern identifiziert und zum Patent angemeldet werden. Durch den Einsatz ganzer Zellen oder von Gewebeteilen lassen sich dabei nicht nur einfache Rezeptor-Ligand-Interaktionen analysieren, sondern auch sehr komplexe Interaktionen innerhalb der Zelle oder im Gewebeverband erfassen. Dieser Ansatz ist inzwischen so weit entwickelt, dass dafür ein Patent erteilt wurde (Patent DE102011121556B4).
Immunkompetente 3D-Hautmodelle
In-vitro-Modelle erlauben es, molekulare Vorgänge bei Wirt-Pathogen-Interaktionen zu analysieren. Besonders epitheliale Modelle sind in der Infektionsforschung geeignet, um die Interaktion zwischen Pathogenen und Wirtsoberflächen zu untersuchen. Denn schwerere Verläufe gehen in der Regel von Mikroorganismen aus, die natürlicherweise die epithelialen Oberflächen des Körpers – Haut, Schleimhäute und den Magen-Darm-Trakt –besiedeln.
Infektionen mit fakultativ pathogenen Mikroorganismen gehören zu den am schwierigsten zu kontrollierenden Infektionserkrankungen in unseren Kliniken. Insbesondere in der Pflege oder bei langliegenden Patienten und Intensivpatienten führen Infektionen mit Bakterien wie Staphylococcs aureus (MRSA) oder Pilzen wie Candida albicans – die normalerweise vom Körper gut kontrollierbar sind – zu schwerwiegenden Erkrankungen, oft mit Todesfolge.
Zur Überprüfung von Infektionsmechanismen dieser fakultativ pathogenen Mikroorganismen stehen am IGB eigens entwickelte In-vitro-Infektionsmodelle zur Verfügung, welche Infektionen in humanen Gewebemodellen abbilden können. An den epithelialen Barrieren im Menschen entscheidet vor allem das angeborene Immunsystem darüber, ob es zu einer Invasion der Pathogene in den Körper und nachfolgend zu einer Infektion kommt. Die angeborenen Abwehrmechanismen gegen Pathogene sind dabei stark abhängig von der Kommunikation der verschiedenen Zelltypen in einer dreidimensionalen Gewebestruktur.
Diese komplexe Ausgangssituation war Anlass zur Entwicklung von 3D-Infektionsmodellen der Haut, die neben den epithelialen Zellen (Keratinozyten) sowohl strukturelle Bestandteile wie dermale Fibroblasten und Kollagen als auch immunologisch relevante Komponenten wie verschiedene Immunzelltypen enthalten. Solche Modelle wurden bereits zur Untersuchung von Mechanismen der Wirt-Pathogen-Interaktion eingesetzt, wobei bislang insbesondere Infektionsvorgänge bei Pilzen (Candida spp.) und Viren (Herpes simplex-Virus, HSV-1) und die Abwehrmechanismen gegen diese Erreger analysiert wurden.
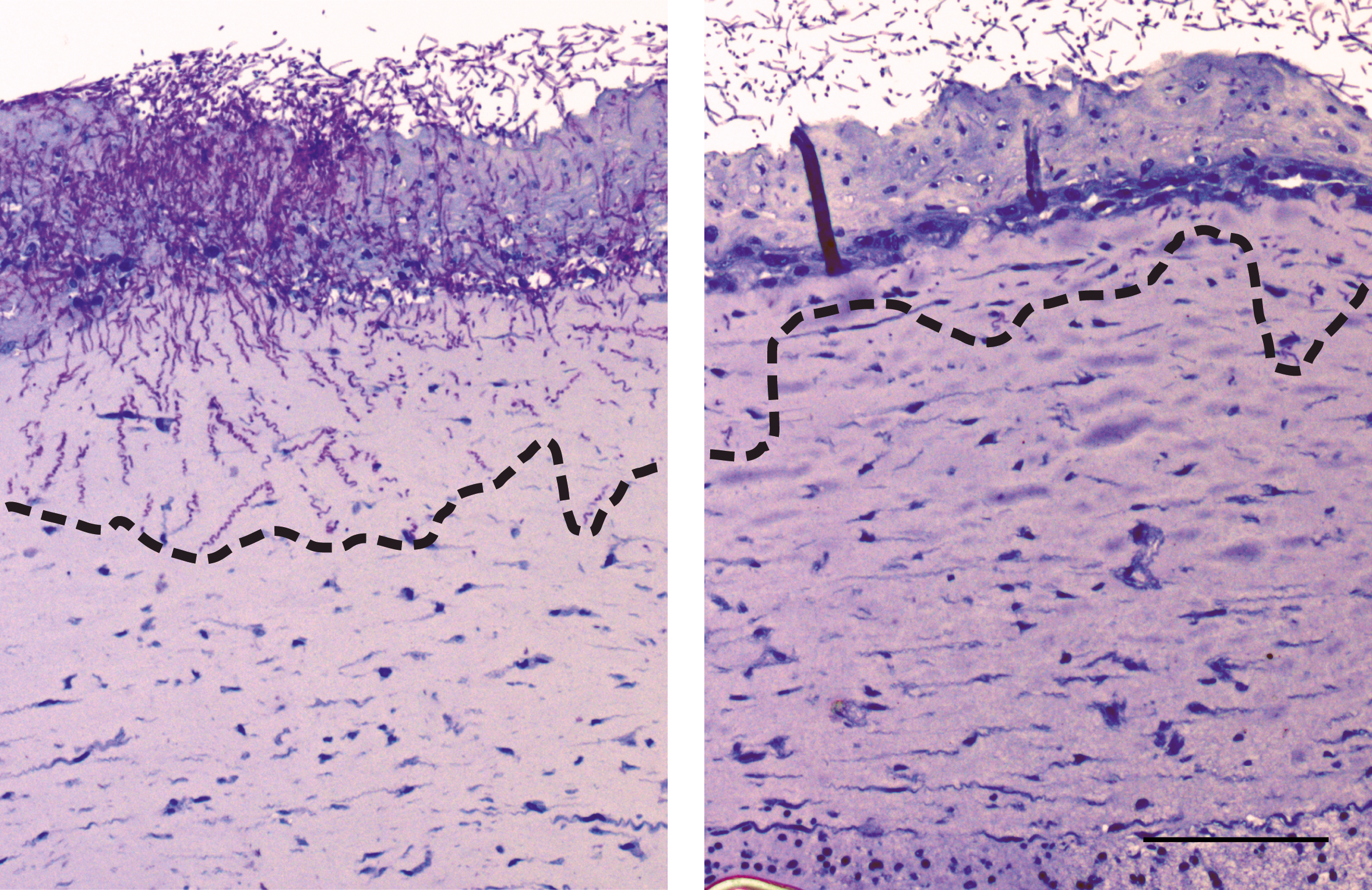
Mithilfe von genomweiten Analysemethoden wie der Next-Generation-Sequenzanalyse können die mit Immunzellen bestückten Infektionsmodelle umfassend analysiert werden. Dabei konnten wir zeigen, dass keiner der individuellen Zelltypen für sich alleine eine effektive Abwehr des Pathogens (in diesem Fall C. albicans) erreichen kann. Vielmehr ist eine Zytokin-vermittelte Kommunikation zwischen den verschiedenen Zelltypen notwendig, um eine effektive antimikrobielle Antwort durch die im Modell vorliegenden dermalen Fibroblasten auszulösen. Eines der Schlüsselmoleküle, ist der für die Erkennung des Pathogens notwendige Immunrezeptor TLR2. Dieser induziert eine Signalkaskade, die die Pilzinvasion letztendlich zum Stillstand bringt.
Diese Ergebnisse unterstreichen die Rolle von Immunrezeptoren als wichtige Sensoren und Regulatoren des Immunsystems, die dem Körper helfen zu entscheiden, wann und wie die körpereigenen Abwehrmechanismen aktiviert werden müssen. Die immunkompetenten Hautmodelle sind deshalb optimal geeignet, um immunmodulatorische Substanzen zur Bekämpfung von Infektionen (oder immunologischen Erkrankungen) zu identifizieren und zu validieren. So können immunaktivierende Wirkstoffe für eine schnellere Beseitigung einer Infektion sorgen und immunsupprimierende Substanzen überschießende Entzündungsreaktionen abmildern.
Mit diesem Ansatz kann das körpereigene Arsenal gegen Pathogene viel stärker in therapeutische Ansätze einbezogen und so ein schnelleres Abklingen von Infektionskrankheiten und ein besserer Schutz vor Infektionen erreicht werden. Diese vielversprechenden Ansätze, teilimmunkompetente In-vitro-Modelle aufzubauen, werden weiter ausgebaut, um die molekularen Mechanismen der körpereigenen Abwehr an Epithelien besser zu verstehen und auf dieser Basis neue Wirkstoffe für die Therapie von Infektionserkrankungen zu entwickeln. Dies ist insbesondere bei immunsupprimierten Patienten deren Immunsystem geschwächt ist, relevant.
»Reporterhaut« – schneller optischer Nachweis von Immunreaktionen bei der Wirkstoffentwicklung
Die Interaktion und Kommunikation zwischen verschieden epithelialen Zellen und Immunzellen ist essenziell, um eine zielgerichtete Immunantwort gegen Pathogene zu aktivieren. Eine fehlgeleitete Kommunikation hingegen führt zu immunmediierten Erkrankungen. Screening- und Validierungssysteme, die schnell und effizient Substanzen für Infektionen oder Entzündungserkrankungen identifizieren und valideren sollen, müssen deshalb auf dreidimensionalen Gewebeäquivalenten basieren.
Um diese Bedingungen annähernd zu erfüllen, wurde am IGB ein System entwickelt, mit dem eine Immunreaktion in einem dreidimensionalen Hautäquivalent optisch erfasst werden kann. Hierfür wurden Reportersysteme für die Aktivierung von Rezeptoren des angeborenen Immunsystems (PRRs) in verschiedene Zelltypen des oben beschriebenen 3D-Hautmodells eingebracht. Dabei können sowohl transient exprimierende Primärzellen wie auch stabil transfizierte immortalisierte Zellen eingesetzt werden.
Die 3D-Reporter-Hautmodelle ermöglichen es, die Aktivierung und Hemmung von zentralen Signalwegen des angeborenen Immunsystems im dreidimensionalen Gewebezusammenhang quantitativ über eine optisch/spektroskopische Auswertung zu erfassen (Patent DE102011121556B4).
Damit kann nicht nur der zeitliche Ablauf einer Infektion, sondern auch der Effekt von Wirkstoffen auf den Verlauf der Infektion quasi »in Echtzeit« an einem bzw. wenigen Gewebemodellen verfolgt werden. Durch die Verwendung unterschiedlicher Reporterzellen und Immunzellen, die in das System integriert werden, können damit auch komplexe Infektionsprozesse an epithelialen Barrieren beschrieben und für die weitere Wirkstoffentwicklung genutzt werden.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB