Kultur, Herstellung und Charakterisierung von humanpathogenen Viren
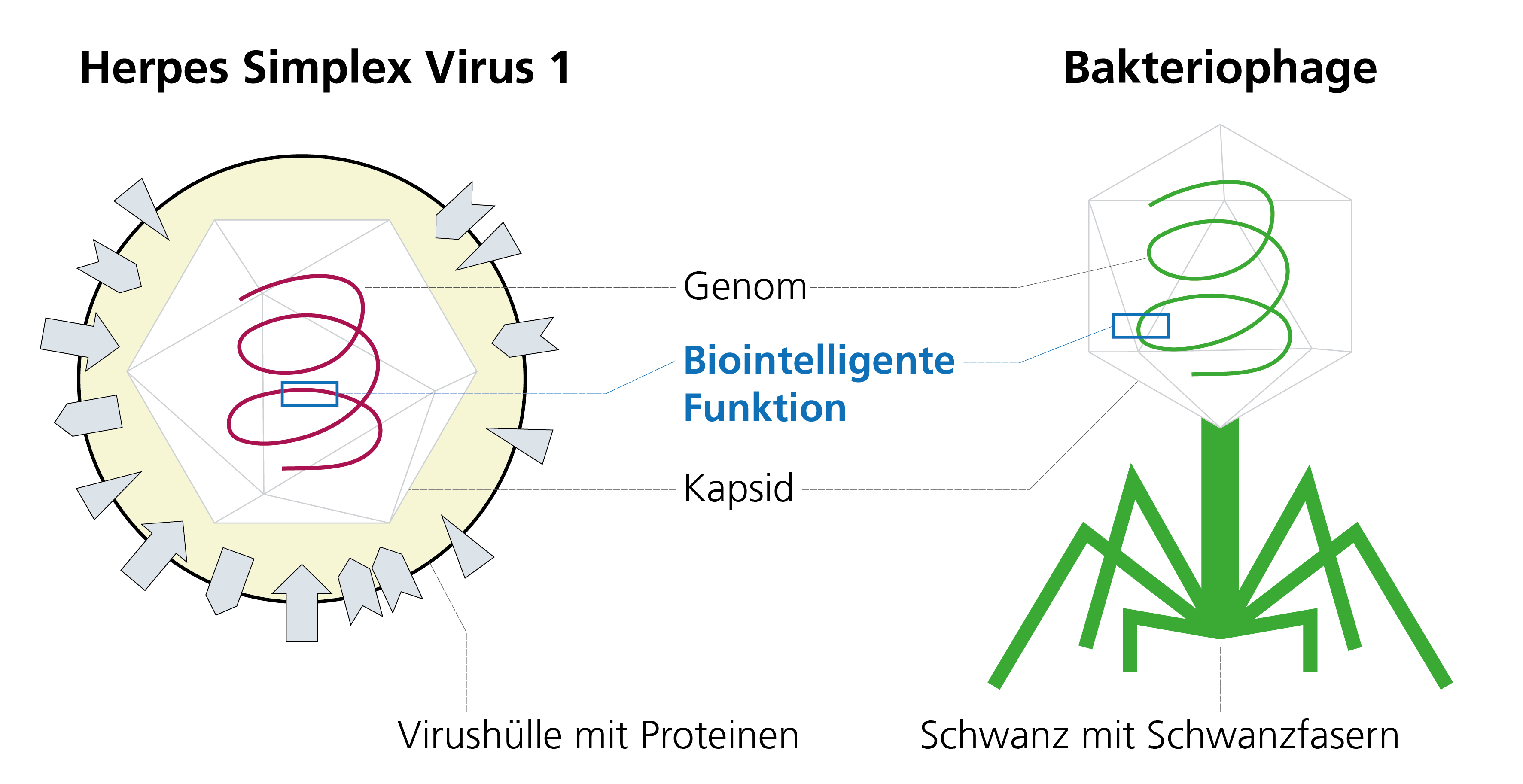
Viren sind kleinste Erreger, die Mensch und Tier in großer Vielfalt bedrohen und zu Krankheiten führen. Ihre Infektionsmechanismen zu verstehen, sie diagnostisch zu erfassen sowie Ansätze zur gezielten Prävention (Vakzine) und Therapie (antivirale Moleküle) zu entwickeln, sind zentrale Anliegen der Arbeitsgruppe von Prof. Bailer.
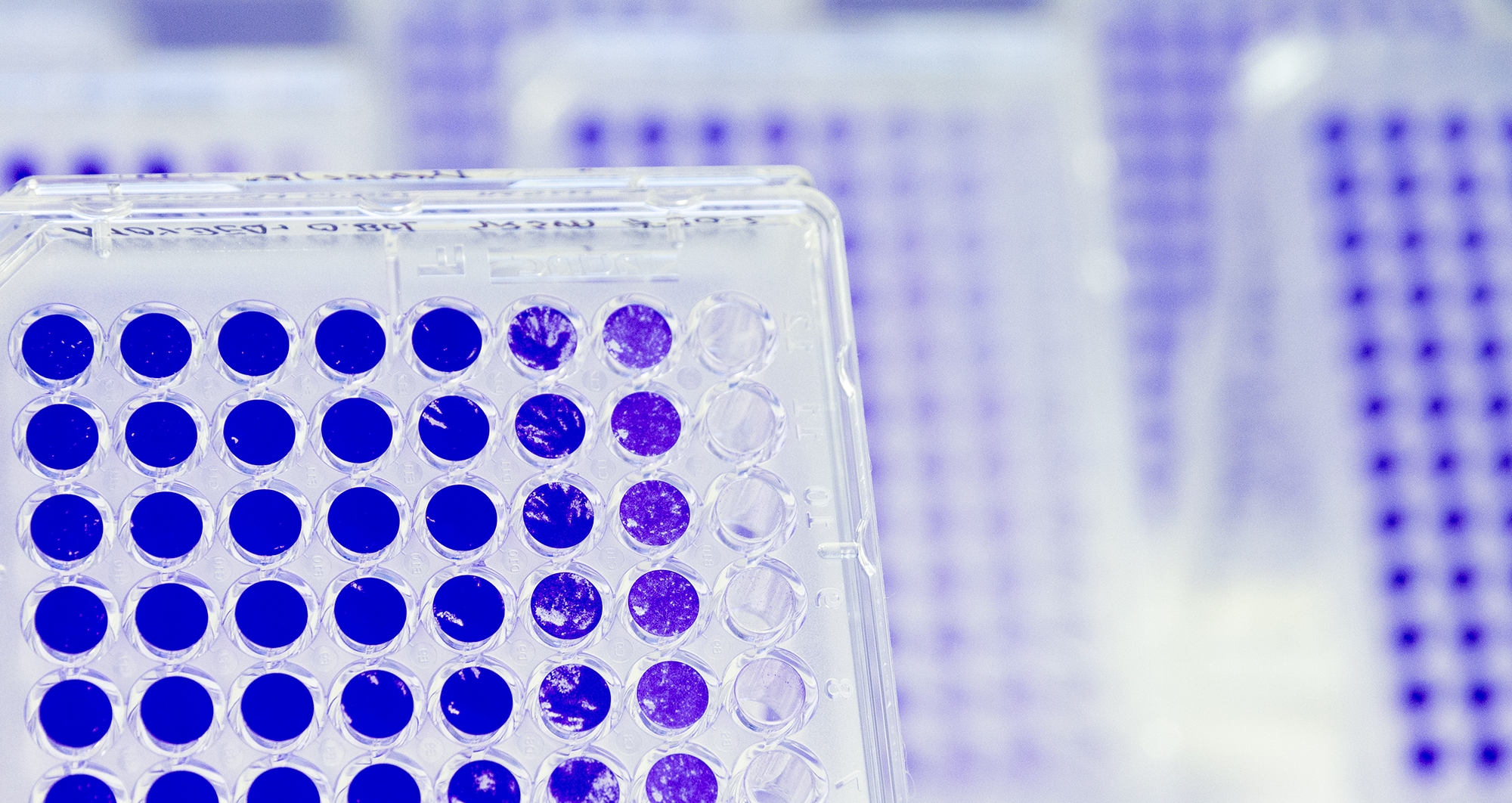
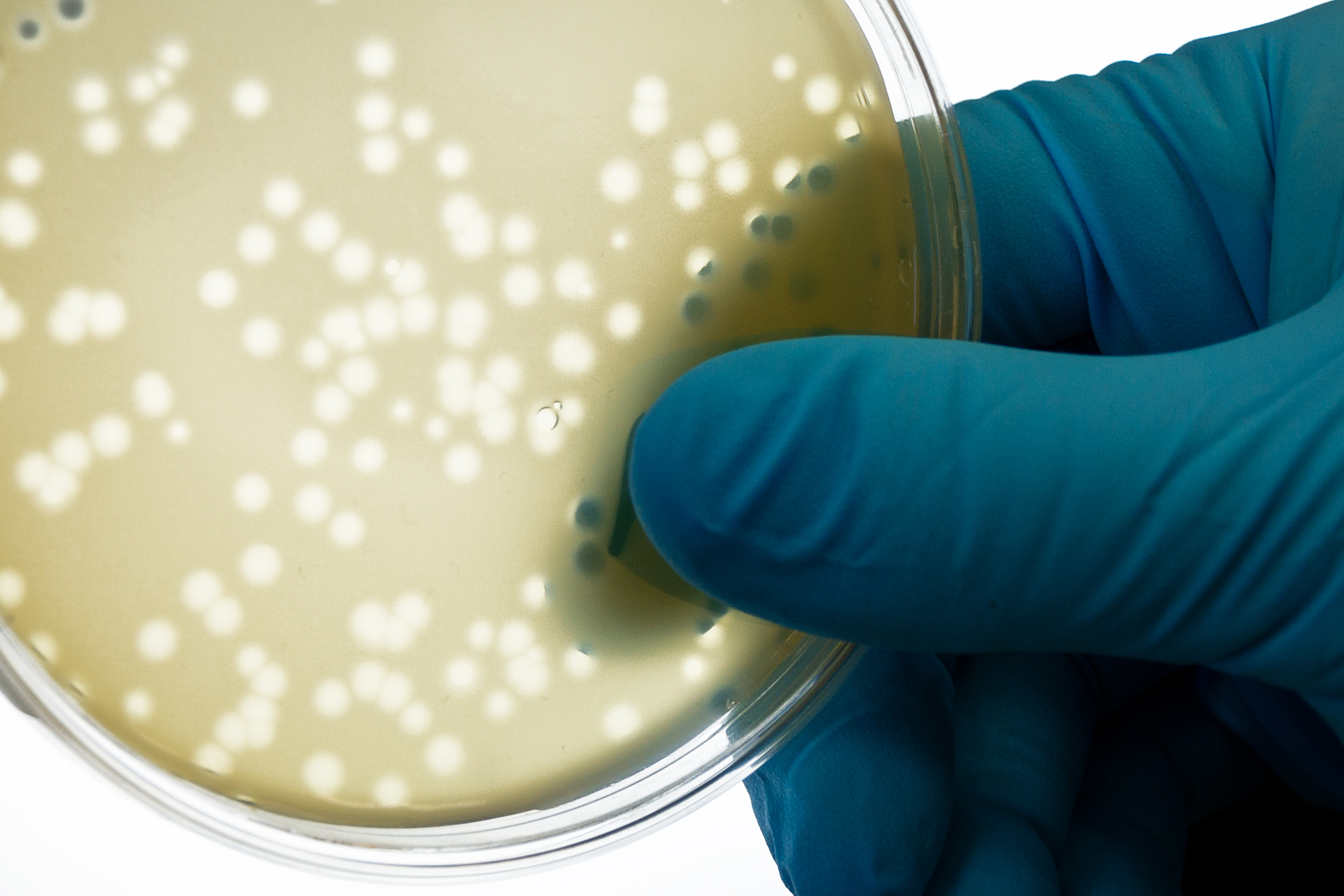
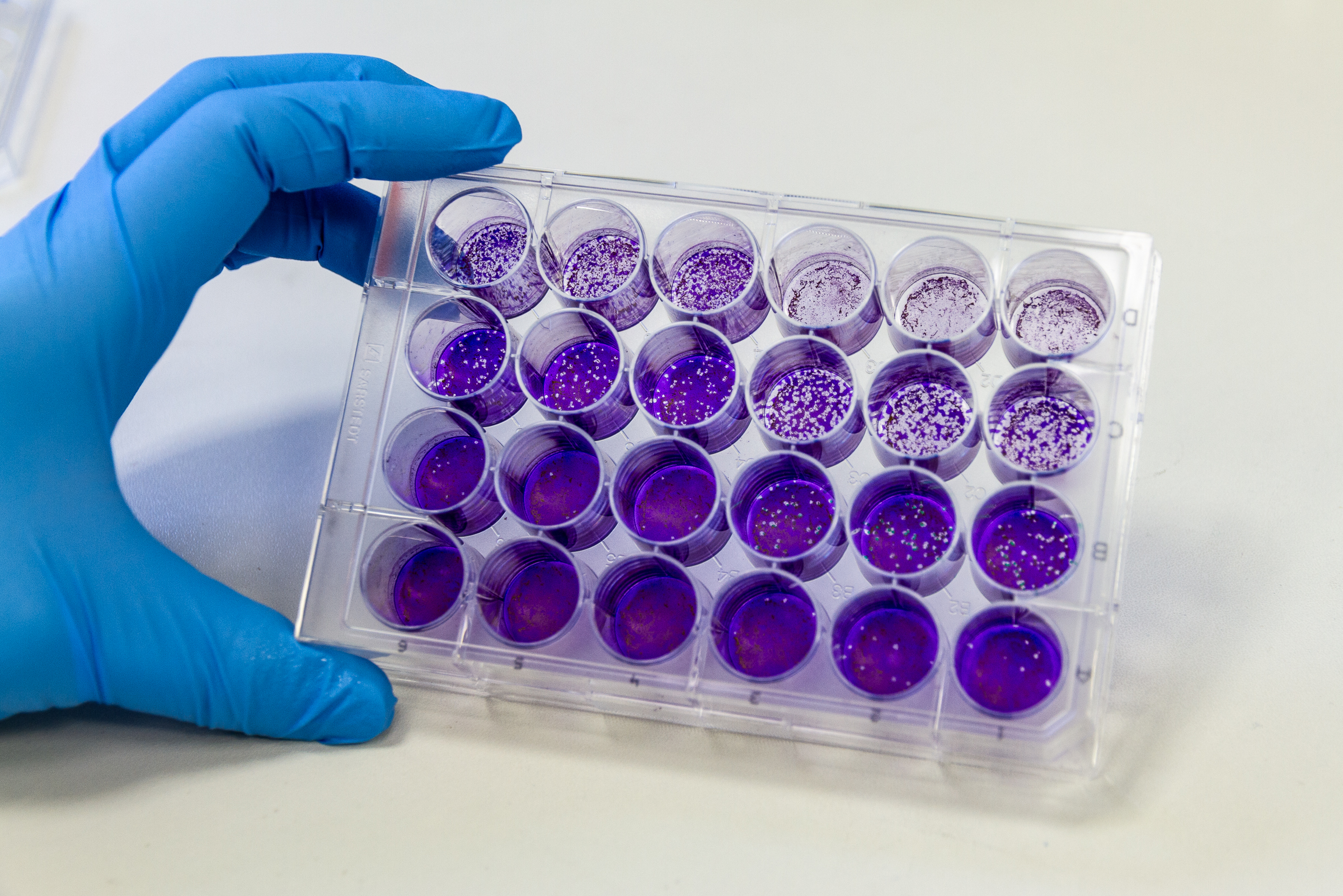
Mit unserer virologischen, zellbiologischen und molekularbiologischen Erfahrung und Infrastruktur bieten wir die Kultivierung, Herstellung und den Nachweis von ausgewählten humanpathogenen Viren an. Zur Charakterisierung und weiteren Untersuchung stehen direkte und indirekte Nachweismethoden zur Verfügung.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB