Der Patentschutz für die ersten Biopharmazeutika läuft vielfach in den kommenden Jahren aus. Die Herstellung sogenannter Biosimilars oder Biogenerika gewinnt dadurch an Bedeutung. Ein erheblicher Anteil der Herstellungskosten eines pharmazeutischen Proteins geht auf eine aufwendige Aufreinigung zurück. Fortschritte im Bereich der analytischen Charakterisierung der Produkte bringen das Dogma »der Prozess bestimmt das Produkt« ins Wanken. Diese Fortschritte eröffnen neue Wege zur Herstellung sicherer und aufgrund alternativer Reinigungsverfahren preisgünstiger Biopharmazeutika, die so weltweit für mehr Patienten zugänglich werden.
Verbessertes Aufarbeitungsverfahren für Gerinnungsfaktor FVII
Blutgerinnungsfaktor VIIa
Für den Gerinnungsfaktor VIIa (FVIIa), einen der für die Blutgerinnungskaskade essenziellen Faktoren, hat das Fraunhofer IGB beispielhaft ein verbessertes rekombinantes Herstellverfahren und Aufarbeitungsverfahren entwickelt. Faktor VIIa ist ein Glycoprotein mit N- und O-Glycosylierungen, das als weitere Modifikation mehrere gamma-Carboxy-Glutaminsäurereste (Gla) im N-terminalen Bereich enthält. Es zeichnet sich damit durch eine Ladungsheterogenität aus, die sich in der isoelektrischen Fokussierung zeigt. Die ursprünglichen Glutaminsäurereste werden posttranslational in einem komplexen, Vitamin-K-abhängigen Prozess modifiziert. Diese Modifikationen binden zweiwertige Kationen. Unter physiologischen Bedingungen sind dies Calciumionen.
Kostenintensive Aufarbeitung aufgrund komplexer Medien
Das von der Herstellerfirma Novo zugelassene Produkt wird mit gentechnologisch veränderten tierischen Zellen in Medien, die fötale Kälberseren (fetal calf serum, FCS) enthalten, exprimiert und exportiert. Die komplexe Zusammensetzung der Medien, in denen das Zielprotein nur als minore Komponente enthalten ist, erschwert die Aufarbeitung, das Downstream Processing (DSP). So müssen alle FCS-Mediumsbestandteile und Proteine aus lysierten Zellen mittels mehrstufiger Trennverfahren abgetrennt werden. Höchste Selektivitäten zeigen Verfahren der Affinitäts-chromatographie. In diesem Fall wird die Immun-Affinitätschromatographie eingesetzt, wobei immobilisierte, gegen das Zielprotein gerichtete Antikörper (AK) die Zielproteine mit hoher Selektivität binden. Die anschließende Spaltung des AK-Protein-Verbunds und damit die Elution des Zielproteins müssen unter Bedingungen erfolgen, unter denen weder das Zielprotein noch der immobilisierte Antikörper geschädigt wird. Für das DSP des Zielproteins muss also kostenintensiv ein speziell geeigneter, proprietärer monoklonaler Antikörper entwickelt, in einer Zelllinie exprimiert, immobilisiert und aufgrund eines nicht sicher vermeidbaren Abbaus der Trägermaterialien in nachfolgenden Reinigungsstufen vom Zielprotein abgetrennt werden.
Vorteilhafte Aufreinigung bei definierten Medien
Fortschritte im Verständnis von Metabolismus und Physiologie tierischer Zellen machen neuartige Medien für die Zellkultur möglich, die ohne Zusatz komplexer, schlecht definierter Bestandteile wie FCS auskommen. Daraus resultiert eine verbesserte Produktreinheit und -sicherheit. Zudem bieten definierte Medien Chancen für ein einfacheres und kostengünstigeres DSP, bei dem ausschließlich kommerziell verfügbare, vergleichsweise preisgünstige Standardtrennmedien wie Ionenaustauscher (IEX), hydrophobe Interaktionschromatographie (HIC) und Gelfiltration eingesetzt werden. Für solche Trennmedien sind die zulassungsrelevanten Unterlagen bereits hinterlegt, müssen also nicht vom Hersteller erstellt und eingereicht werden. Am Fraunhofer IGB verwenden wir für die rekombinante Herstellung von Faktor VII ein spezielles, serumfreies und wenig proteinhaltiges Medium, in das Faktor VII als Proenzym sekretiert wird.
Ergebnisse: Reinigung mit hoher Selektivität
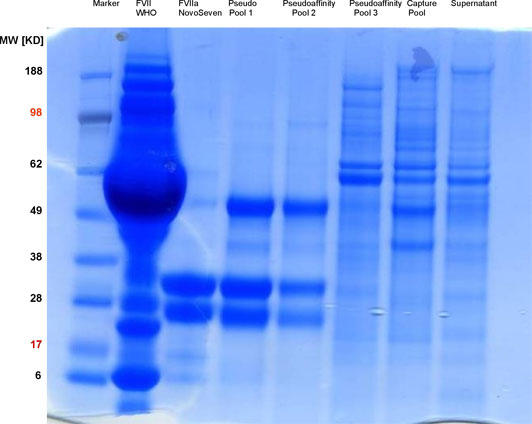
Für die Reinigung von FVII und die Aktivierung zum FVIIa haben wir Anionenaustauschermaterialien eingesetzt. Hohe Selektivitäten konnten wir durch die speziellen Eigenschaften des Zielproteins erreichen, dessen Nettoladung über die Calciumkonzentration beeinflusst wird. Bei niedrigen Konzentrationen freier Calciumionen liegen die gamma-Carboxy-Glutaminsäurereste zweifach negativ geladen vor, mit gebundenem Calcium sind diese Ladungen neutralisiert. Die Nettoladung der Proteinmoleküle beeinflusst das Bindungs- und Elutionsverhalten am Ionenaustauscher. Mit einer Kombination von zwei Trennschritten an Anionenaustauschermaterialien, bei denen die Konzentration freier Calciumionen variiert wurde, konnten wir so eine Reinigung mit hoher Selektivität erreichen. Derartige hochselektive Trennverfahren mit Standardtrennmedien werden auch als »Pseudoaffinitätschromatographie« bezeichnet.
Da Faktor VII an positiv geladenen Grenzflächen und damit auch an Anionenaustauschermaterialien unter geeigneten Bedingungen zum Zielprotein Faktor VIIa umgesetzt werden kann, wird ein Reinigungsschema, bei dem ausschließlich Anionenaustauscher und Membranverfahren eingesetzt werden, und damit eine kostengünstigere Herstellung dieses Biogenerikums möglich.
Projekt
Development of a Production Process for Recombinant Factor VII
- Projektpartner: CinnaGen Inc., Teheran
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB