Literatur
1. Burger-Kentischer, A.; Finkelmeier, D.; Keller, P.; Bauer, J.; Eickhoff, H.; Kleymann, G.; Abu Rayyan, W.; Singh, A.; Schroppel, K.; Lemuth, K.; Wiesmuller, K. H.; Rupp, S. (2011) A screening assay based on host-pathogen interaction models identifies a set of novel antifungal benzimidazole derivatives, Antimicrobial agents and chemotherapy 55 (10): 4789-4801. doi:10.1128/AAC.01657-10
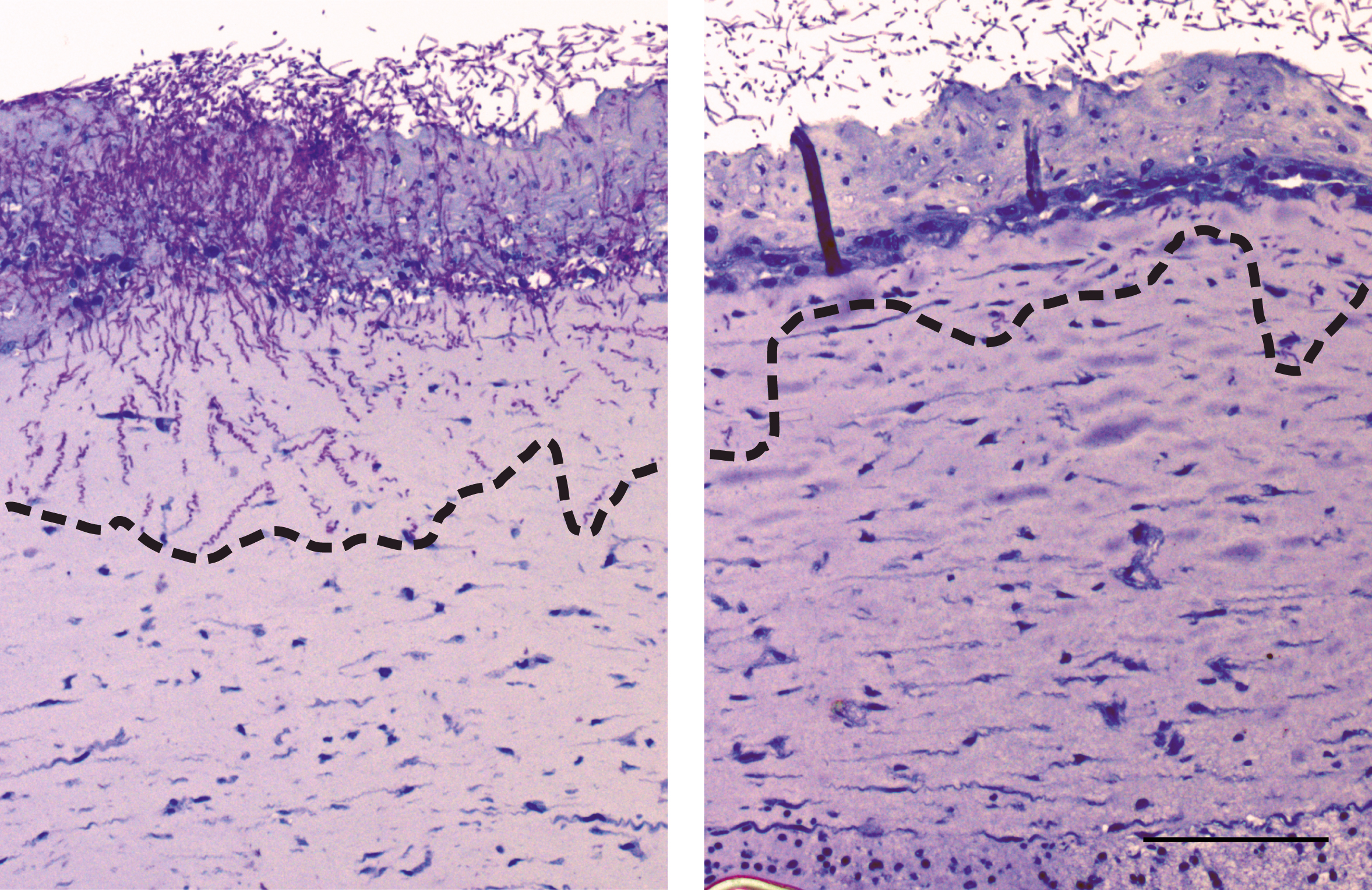
2. Dieterich, C.; Schandar, M.; Noll, M.; Johannes, F.J.; Brunner, H.; Graeve, T.; Rupp, S. (2002) In vitro reconstructed human epithelia reveal contributions of Candida albicans EFG1 and CPH1 to adhesion and invasion, Microbiology 148 (Pt 2): 497-506
3. Burger-Kentischer, A.; Abele, I. S.; Finkelmeier, D.; Wiesmuller, K. H.; Rupp, S. (2010) A new cell-based innate immune receptor assay for the examination of receptor activity, ligand specificity, signalling pathways and the detection of pyrogens, Journal of immunological methods 358 (1-2): 93-103. doi:10.1016/j.jim.2010.03.020
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB