Neues Interferon-beta
Interferon-beta ist ein körpereigenes menschliches Protein, das die Verbreitung von Viren unterdrückt. Daneben ist es unverzichtbar zur Behandlung von Multipler Sklerose. Durch »Hydrophobicity Engineering« konnte die Löslichkeit des Proteins verbessert werden.
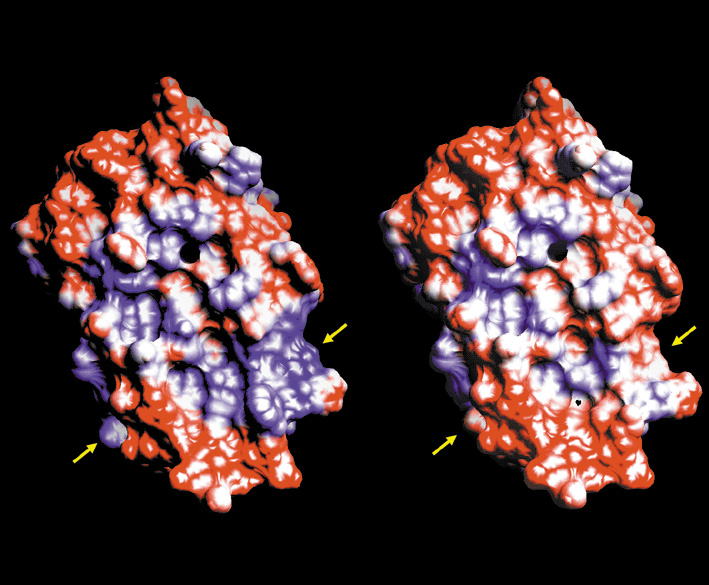
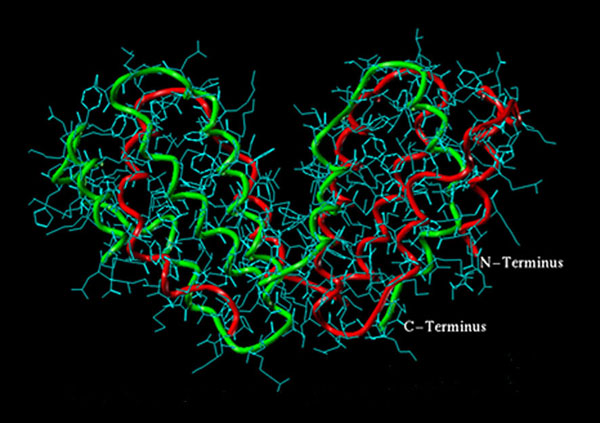
Interferone sind körpereigene Proteine des Menschen, die sich zur Behandlung verschiedener Krankheiten eignen. Interferon-beta ist beispielsweise einer der wenigen Wirkstoffe, mit dem sich Multiple Sklerose behandeln läßt. Ein großes Problem ist jedoch die geringe Löslichkeit des Proteins. Mit einem neuartigen Konzept für Proteindesign, dem Hydrophobicity Engineering, wollen Wissenschaftler des Fraunhofer-Instituts für Grenzflächen- und Bioverfahrenstechnik IGB die wasserabweisenden – hydrophoben – Regionen des Moleküls durch löslichere ersetzen. Ziel ist, die Zusammenlagerung der Moleküle zu reduzieren, um die Proteinausbeute zu steigern und die pharmakologische Wirksamkeit zu erhöhen. Die Proteinvarianten werden mit gentechnologischen Methoden konstruiert, in Bakterienzellen produziert und dann von allen bakteriellen Proteinen gereinigt, bis hochreines Interferon beta vorliegt.
Dafür mußten die Forscher als erstes ein Strukturmodell des menschlichen Interferon-beta bestimmen. Grundlage war die dreidimensionale Kristallstruktur des Interferon-beta der Maus. Denn Struktur und Aufbau dieser Proteine sind bei Mensch und Maus sehr ähnlich. »Über homologiebasierte Modellierung konnten wir die Struktur des menschlichen Interferon-beta-Proteins nachbilden«, berichtet Christian Schneider-Fresenius aus dem IGB. »Wir sind diesen Weg gegangen, weil die Kristallstruktur des menschlichen Interferon beta zu dem Zeitpunkt, als die Arbeiten begannen, nicht vorlag«. Mittlerweile haben Wissenschaftler aus den USA die Kristallstruktur des humanen Proteins gelöst. Vergleiche zeigen, daß die Modellierung der Struktur das gleiche Ergebnis lieferte. Anschließend arbeiteten die Forscher aus dem IGB daran, die Aminosäuren zu identifizieren, die für die schlechte Löslichkeit verantwortlich sind und tauschten sie gegen andere, löslichere aus. Dadurch wurden die biophysikalischen Grundeigenschaften des Proteins verbessert, ohne die biologische Aktivität zu verändern.
Die Arbeiten der Fraunhofer-Forscher zeigen, dass Proteindesign mit großen, intakten Proteinen sehr genaue Kenntnisse über die Struktur-Funktionsbeziehungen sowie die physiko-chemischen Wechselwirkungen am Protein erfordern. Damit zeigen die Wissenschaftler einen zukünftigen Weg der Arzneimittelforschung auf: Um hochspezifische Wirkstoffe für bislang unbesiegte Krankheiten zu entwicklen, sind natürliche Proteine unersetzbar. Bis aber maßgeschneiderte Proteine mit gezielt veränderten Eigenschaften für den Einsatz im Patienten zur Verfügung stehen, wird es noch einige Zeit dauern.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB